L’ inflammation comme vous ne l’avez jamais vue :
conséquences pratiques pour le traitement de
nombreuses maladies
Serge Martinod
Directeur Scientifique ArcaNatura
L’ inflammation est un phénomène immunologique d’importance vitale.
- C’est la première ligne de défense de l’animal contre une agression externe ou un stimulus interne
- Elle est définie comme une réponse protectrice localisée d’un tissu vascularisé à une lésion de type mécanique (trauma ou altération du cartilage), biologique (infection) ou chimique
- Elle se déroule classiquement en trois phases : induction-expression-résolution.
Elle est caractérisée par les signes cliniques suivants
- Rougeur : augmentation du flot sanguin
- Enflure : exsudation, œdème des tissus
- Chaleur : augmentation du flot sanguin
- Douleur : présence de médiateurs chimiques et compression de terminaisons nerveuses
- Perte de fonction : œdème, douleur ou dommage tissulaire.
La découverte de nouveaux médiateurs moléculaires et acteurs cellulaires nous oblige à repenser l’ inflammation et à la considérer comme un phénomène complexe ne pouvant pas uniquement être contrôlé par les médicaments traditionnels comme les anti-inflammatoires non stéroïdiens. Le but de cette présentation est de décrire ces nouveaux concepts au cours des trois phases de la réaction inflammatoire et d’introduire les implications thérapeutiques qui en découlent. Nous prendrons deux exemples, l’ostéoarthrite et la cystite idiopathique féline.
1- L’OSTÉARTHRITE
a- Causes et facteurs de risque
Les facteurs de risque et les causes de l’ostéoarthrite sont nombreux. Les principaux facteurs favorisants sont l’âge et l’obésité, mais les fractures, antécédents traumatiques articulaires, chirurgies, hyperlaxités ligamentaires, certaines activités physiques et des facteurs génétiques (dysplasies…) peuvent aussi jouer un rôle. L’obésité est particulièrement intéressante car elle est responsable d’ostéoarthrite à deux niveaux : soit par le stress mécanique appliqué sur l’articulation en raison du surpoids, soit par l’intermédiaire des adipokines. Les adipokines, principalement la leptine, sont des cytokines secrétées par le tissu adipeux qui contribuent au risque d’ostéoarthrite à distance du foyer adipeux. La leptine est retrouvée dans le liquide synovial des patients atteints d’ostéoarthrite et son expression dans le cartilage varie en fonction de la sévérité des lésions cartilagineuses. La leptine est capable de modifier les fonctions chondrocytaires.
b- L’articulation normale
Le cartilage est un tissu non vascularisé et non innervé. Il est constitué d’une matrice et d’un seul type cellulaire, le chondrocyte. La matrice est constituée essentiellement d’eau, de collagène et de protéoglycanes (figure 1).
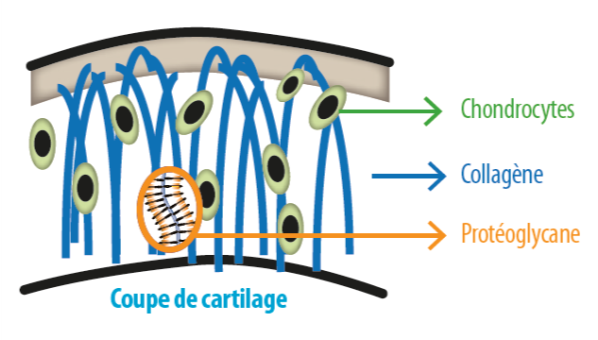 Figure 1 : Structure du cartilage
Figure 1 : Structure du cartilage
Le réseau de fibres de collagène forme une armature solide et assure la compressibilité du cartilage. A l’intérieur de ce réseau les protéoglycanes retiennent l’eau par leur pouvoir hydrophile. Les protéoglycanes sont formés d’une protéine porteuse liée à l’acide hyaluronique sur laquelle viennent s’ancrer des glycosaminoglycanes (GAG) formés de chaînes de chondroïtine sulfate et de kératane sulfate.
Les chondrocytes participent à la production de collagène et de protéoglycanes ; leur métabolisme normal résulte d’un équilibre entre plusieurs types de médiateurs comme des facteurs cataboliques (IL-1β, TNF), des facteurs de croissance (TGF-β, IGF-1) et des facteurs régulateurs (IL-4, IL-10).
La destruction du cartilage dans l’ostéoarthrite est le résultat d’un déséquilibre entre anabolisme et catabolisme de la matrice extracellulaire
c- L’inflammation
Induction
Une hyperpression au niveau du cartilage active des chondrocytes via des récepteurs membranaires sensibles à la pression. Les chondrocytes produisent des médiateurs de l’inflammation, cytokines comme IL-1 ,IL-17, TNF, prostaglandines comme PGE2, des enzymes (métalloprotéinases MMP et aggrécanases ADAMT) et des dérivés oxygénés comme le monoxyde d’azote (NO). Ces médiateurs sont à l’origine de la destruction de la matrice cartilagineuse (collagène et protéoglycanes).
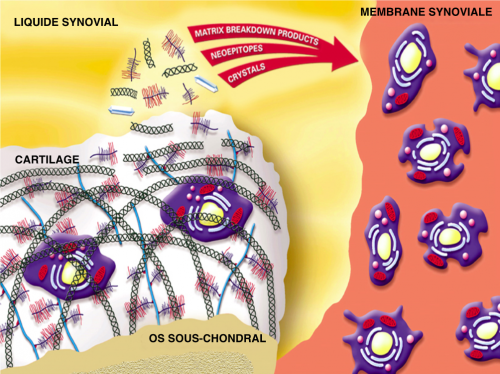
Figure 2 : Induction de l’ inflammation
Expression
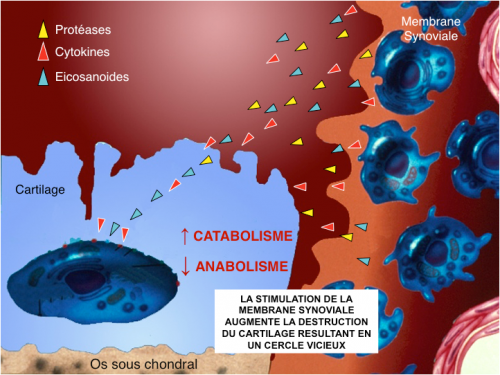
Des produits de dégradation du cartilage et des substances solubles (cytokines) vont être libérés dans le liquide synovial et phagocytés par la synoviale qui va répondre par un processus inflammatoire. Par conséquent, macrophages, synoviocytes et fibroblastes vont à leur tour produire radicaux libres, PGE2, cytokines (IL-1 et TNF) et enzymes (MMPs, collagénases) qui vont renforcer la destruction du cartilage. De plus, l’os sous-chondral est aussi impliqué en libérant des médiateurs solubles qui traversent l’interface os-cartilage pour aller détruire les couches profondes du cartilage dès les stades précoces de la maladie.
Figure 3 : L’ostéoarthrite
Résolution
Sans contrôle, une réaction inflammatoire peut devenir destructrice pour les tissus. La résolution de l’inflammation a longtemps été considérée comme un processus passif. En réalité, des mécanismes de contrôle existent et permettent la résolution de l’inflammation, évitant le passage à l’état chronique ou la formation de tissu fibreux avec perte de fonction. Cette phase de retour à l’homéostasie est coordonnée par des médiateurs pro-résolution, les résolvines D et E et les protectines. Ces médiateurs sont synthétisés par l’organisme à partir des acides gras insaturés oméga-3 DHA (acide docosahexaénoïque) et dans une plus faible mesure EPA (acide eicosapentaénoïque).
Le rôle de ces médiateurs est maintenant bien établi
- Stopper la migration des neutrophiles
- Stimuler la phagocytose des neutrophiles par les macrophages
- Inhiber les cytokines pro-inflammatoires comme le TNF et L’IL-1β
- Faciliter l’élimination des chémokines
- Freiner la formation de tissus fibreux
- Inhiber la formation d’anions superoxydes.
Il est donc important de favoriser ce système de régulation pour empêcher l’inflammation chronique de s’installer.
d- Conséquences sur la stratégie thérapeutique
Cette stratégie doit être multimodale.
Pendant la phase d’induction
– Agir sur les causes et les facteurs de risques
- Facteurs mécaniques : diminution de la laxité articulaire par chirurgie, exercice modéré ou physiothérapie…
- Obésité : l’importance du régime alimentaire et de l’exercice est bien connue. Récemment l’administration journalière d’acide hyaluronique sous une forme brevetée (Oralvisc® Bioiberica) à des patients humains obèses avec arthrose du genou pendant trois mois a permis d’observer une réduction du taux de leptine dans le sang et le liquide synovial corrélée à une amélioration des signes cliniques (Nelson et al 2015 Rheumatol. Int. 35:43-52).
– Protéger le cartilage : les chondroprotecteurs
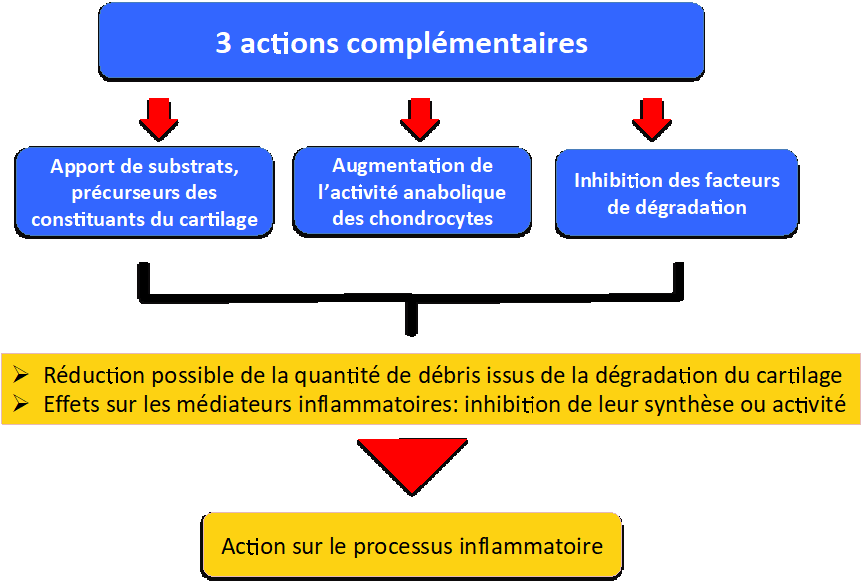
Ce sont des traitements destinés à protéger le cartilage, détruit en cas d’ostéoarthrite. Leur mode d’action est résumé sur la figure 4.
Figure 4 : Rôle général des chondroprotecteurs
Tous les chondroprotecteurs ne sont pas équivalents. L’utilisation d’un sulfate de chondroïtine pur et de faible poids moléculaire est notamment capitale : ainsi cette substance est mieux absorbée et donc beaucoup plus biodisponible. Les vétérinaires doivent exiger des preuves de sécurité et d’efficacité auprès des fabricants avant de sélectionner un produit pour leurs clients.
– Apport de substrats, précurseurs des constituants du cartilage
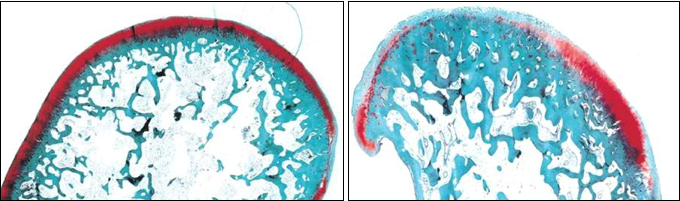
La combinaison de glucosamine et de sulfate de chondroïtine (Cosequin®) agit en synergie, en augmentant la production de glycosaminoglycanes. Par exemple, dans un modèle d’arthrose avec création d’instabilité au niveau du genou chez le lapin, l’administration de Cosequin® a permis de réduire les lésions du cartilage par rapport à un placebo (Lippiello et al 2000 Clin. Othop. Relat. Res. 381 : 229-240).
Traités avec Cosequin® Placebo
Figure 5 : Rôle de protection du cartilage par une combinaison sulfate de chondroïtine/glucosamine/ascorbate de manganèse (Cosequin®)
– Augmentation de l’activité anabolique des chondrocytes
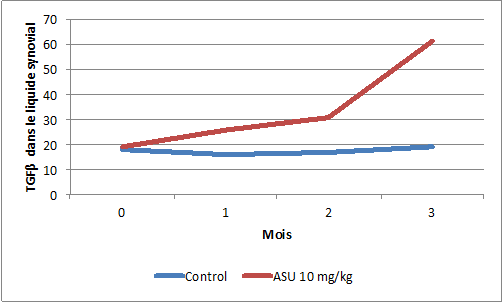
La fraction insaponifiable d’huile d’avocat et de soja (ASU) permet de stimuler la production du TGFβ, un facteur de croissance augmentant la synthèse des chondrocytes et stimulant la production de collagène et de protéoglycanes. Cet effet a été démontré chez le chien dans le liquide synovial (Altinel et al 2007 Tohoku J. Exp. Med 211 : 181-186).
Figure 6 : L’administration d’ASU stimule la production du facteur de croissance TGF-β dans les articulations de chiens.
– Inhibition des facteurs de dégradation
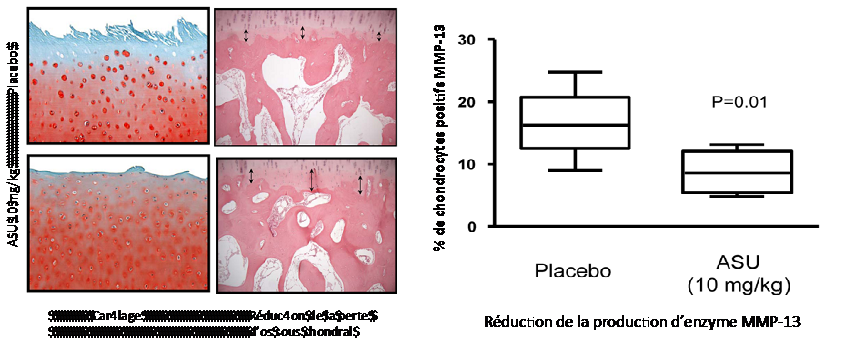
L’administration d’ASU (10 mg /kg) pendant huit semaines à des chiens après résection des ligaments croisés antérieurs a permis une réduction significative du taux de métalloprotéinases au niveau du cartilage (Boileau et al 2009 Arthritis Res. Therap. 11 : R41). Cette réduction est associée à un effet bénéfique au niveau du cartilage.
Figure 7 : Réduction de la production de métalloprotéinases dans le cartilage de chien après administration d’ASU pendant huit semaines.
Pendant la phase d’expression
– Les anti-inflammatoires non stéroïdiens
Les anti-inflammatoires non stéroidiens (AINS) sont les médicaments les plus utilisés chez le chien. Ils ont un double effet, soulager la douleur et limiter l’inflammation. Ils agissent par inhibition des enzymes COX, réduisant ainsi la synthèse des prostaglandines. En raison de leur toxicité à long terme chez certains animaux et de leur mode d’action centré sur une partie seulement de la réaction inflammatoire, d’autres thérapies doivent être employées. De nouveaux AINS avec un mode d’action différent comme les antagonistes des récepteurs de prostaglandines (grapiprant) sont maintenant disponibles.
– Au-delà des AINS : les inhibiteurs des cytokines pro-inflammatoires
Ils sont directement issus des progrès des connaissances quant au rôle de différentes cytokines dites pro-inflammatoires, en particulier du TNFα et de l’IL-1. Les molécules utiles au blocage de ces cytokines sont essentiellement représentées par des anticorps monoclonaux (par exemple anti-TNF ou infliximab) ou des protéines recombinantes (récepteur soluble au TNF Etanercept ou antagoniste du récepteur IL-1). Ces produits sont disponibles seulement en médecine humaine mais des produits similaires devraient arriver sur le marché vétérinaire dans le futur.
Il existe toutefois un produit à effet démontré chez les animaux domestiques : les extraits de la fraction insaponifiable avocat/soja (ASU) agissent en bloquant des médiateurs de l’inflammation comme les cytokines IL-1β et TNF-α., la cyclo-oxygénase-2 (COX-2), la prostaglandine E2 (PGE2) et l’oxyde nitrique (NO).
Figure 8 : La fraction insaponifiable avocat/soja (ASU) permet une réduction significative de la production de cytokines pro-inflammatoires, de COX-2 et d’oxyde nitrique (NO) par des chondrocytes stimulés par le LPS. (Au RY et al 2007, Osteoarthritis and Cartilage 15 : 1249-1255).
Il existe même un effet synergique entre l’ASU et l’association sulfate de chondroïtine/glucosamine (Au RY et al 2007 FASEB J. 21 (6) A736). Ces ingrédients sont réunis dans un nouveau produit : Dasuquin®.
Pendant la Résolution
Les carnivores domestiques ne produisent peu ou pas d’oméga 3 DHA et EPA. Pour une bonne résolution de l’inflammation il faut donc leur en fournir chaque jour par voie orale. En raison des doses importantes nécessaires (supérieures à 15 mg/kg/jour) et de la fragilité de ces molécules (oxydation), il n’est pas possible d’en apporter suffisamment dans la nourriture ; il faut donc utiliser des compléments alimentaires. Le DHA ne se trouve en quantité que dans les produits de la mer comme les poissons, le krill ou les algues unicellulaires du phytoplancton. Du DHA très pur extrait du phytoplancton cultivé en bassin est désormais disponible : Résolution 3®. Le DHA est fragile et sensible à l’air, la lumière et la température. Il ne faut donc utiliser que des compléments alimentaires qui protègent le DHA sous forme de gélules ou de pompes airless conservées au réfrigérateur et à l’abri de la lumière.
2- LA CYSTITE IDIOPATHIQUE FÉLINE
La cystite idiopathique féline est fréquente chez les chats de moins de 10 ans. Elle est provoquée par une interaction complexe entre la vessie, le système nerveux, les glandes surrénales, le stress et l’environnement
Induction
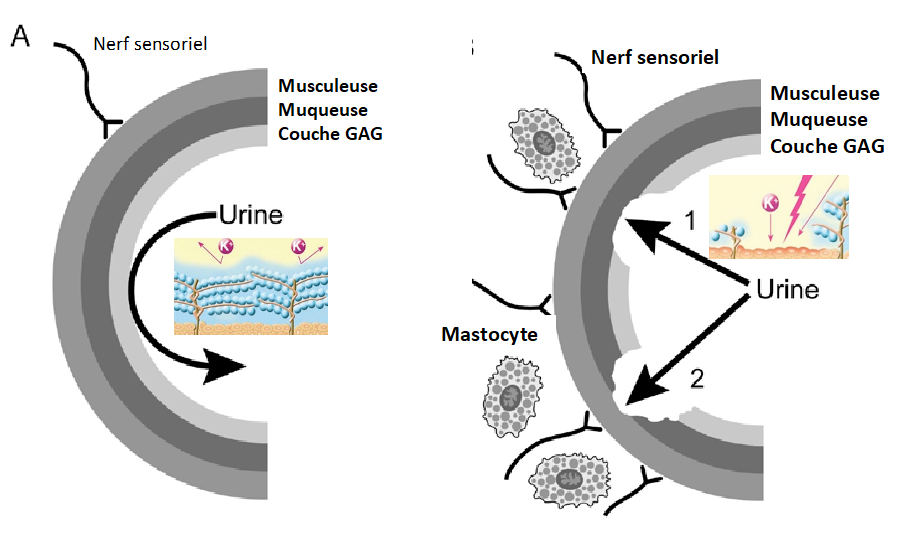
Figure 9 : Vessie normale et altération de la perméabilité urothéliale.
La paroi interne de la vessie est normalement recouverte d’une couche muqueuse contenant des glycosaminoglycanes (GAG), en particulier la chondroïtine sulfate, qui protègent les cellules épithéliales (figure 9).
La diminution du niveau des GAG perturbe cette couche protectrice et permet à des constituants urinaires comme les ions potassium d’envahir l’épithélium (figure 9)
L’expression
Ces constituants toxiques peuvent stimuler les neurones efférents situés dans la sous-muqueuse avec libération de neurotransmetteurs comme la substance P. Ces neurotransmetteurs, en synergie avec d’autres médiateurs comme l’histamine libérée par les mastocytes et de l’oxyde nitrique, sont à l’origine d’une inflammation. Dans ce cas l’inflammation est causée par stimulation neurogénique ; on parle d’inflammation neurogène. Elle présente toutes les caractéristiques d’une inflammation classique (rougeur, douleur, vasodilatation des vaisseaux, œdème) mais avec peu d’implication des médiateurs traditionnels type PGE2.
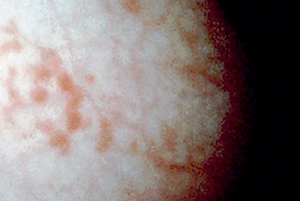
Figure 10 : Urétro-cytoscopie de la vessie pendant une phase de cystite idiopathique avec les signes classiques de l’inflammation.
Traitement
En vertu de ce que nous avons vu précédemment, le traitement fera surtout appel au contrôle de la phase d’induction (gestion du stress, augmentation de la quantité d’eau bue, restauration de la couche GAG par exemple avec Calmurofel®) et au contrôle de la douleur et des spasmes pendant la phase d’expression. Les AINS n’ont pas un rôle majeur dans le traitement de la cystite idiopathique féline.